Ученые выяснили механизм действия микробного ионного насоса
В основе энергетики любой живой клетки лежат процессы, происходящие на мембранах, в частности, направленный перенос (или транспорт) ионов и молекул. Известно огромное число ионных каналов, насосов (помп) и переносчиков, работающих в тех или иных организмах, но подробно изучена работа лишь некоторых из них. Новая работа ученых Центра исследований молекулярных механизмов старения и возрастных заболеваний ЛФИ МФТИ и зарубежных коллег пролила свет на функционирование активируемых светом ионных насосов на примере протеородопсина из морской бактерии. Публикация вышла в Science Advances.
Живые клетки регулируют свою жизнедеятельность за счет множества мембранных белков. Они обеспечивают нужную концентрацию ионов и других соединений внутри клетки и в ее отдельных «отсеках». Ионный транспорт представлен как пассивными процессами при участии каналов и переносчиков («выпускают» ионы туда, где их меньше), так и активными — их обеспечивают ионные насосы. Создаваемые ими ионные дисбалансы нужны для эффективного синтеза АТФ — основной энергосодержащей молекулы живых клеток.
Среди ионных насосов выделяются протеородопсины (PRs, proteorhodopsins). Это важная группа белков морских бактерий, которые используют энергию света для переноса через мембрану протонов (ионов водорода). По названию видно, что протеородопсины — это родственники родопсина, зрительного пигмента глаза, который помогает нам видеть. Родственных белков на самом деле множество — они обнаружены у самых разных организмов от животных до водорослей и даже вирусов.
Однако протеородопсины заметно отличаются от хорошо изученных белков у представителей других доменов жизни — эукариот и архей. Разнообразные белки этой группы реагируют на свет определенной длины волны, поскольку связаны с ретиналем (производное витамина A). Эта небольшая молекула поглощает энергию и изомеризуется, то есть переходит из одной формы в другую и обратно. Можно сказать, что ретиналь работает как активатор белка.
Различные группы бактерий, археи и водоросли-динофлагелляты встроили протеородопсины в свой метаболизм — возможно, чтобы использовать энергию света. Все эти фототрофные микробы служат основой пищевой цепи океана и кормят других его жителей.
Несмотря на важность для морских экосистем и двадцатилетние усилия ученых, механизмы транспорта ионов водорода с помощью протеородопсинов оставались не вполне ясны. Не хватало полученных с высоким разрешением структур таких белков, соответствующих различным функциональным состояниям. Да и в исходном виде структуры протеородопсинов имели недостаточное разрешение — например, в моделях отсутствовали координаты некоторых молекул воды. Предстояло узнать, как такие молекулы меняются в ходе фотоцикла — обратимых перестроек структуры, происходящих в несколько стадий.
Пробел восполнила новая статья международного коллектива исследователей. Объектом изучения стал протеородопсин MAR, ген которого выделили из морской актинобактерии Actinomarina minuta. Ученые построили эволюционное древо протеородопсинов, включая MAR, и установили его родственные связи. Оказалось, что это типичный представитель обширного семейства микробных родопсинов.
При этом MAR — очень небольшой белок, состоящий всего из 220 аминокислотных остатков. Поэтому его сочли подходящей минималистической моделью ионной помпы. MAR имеет семь проходящих через мембрану спиралей (от A до G). Их соединяют короткие петли снаружи и внутри клетки, а молекула ретиналя пришита к спирали G.
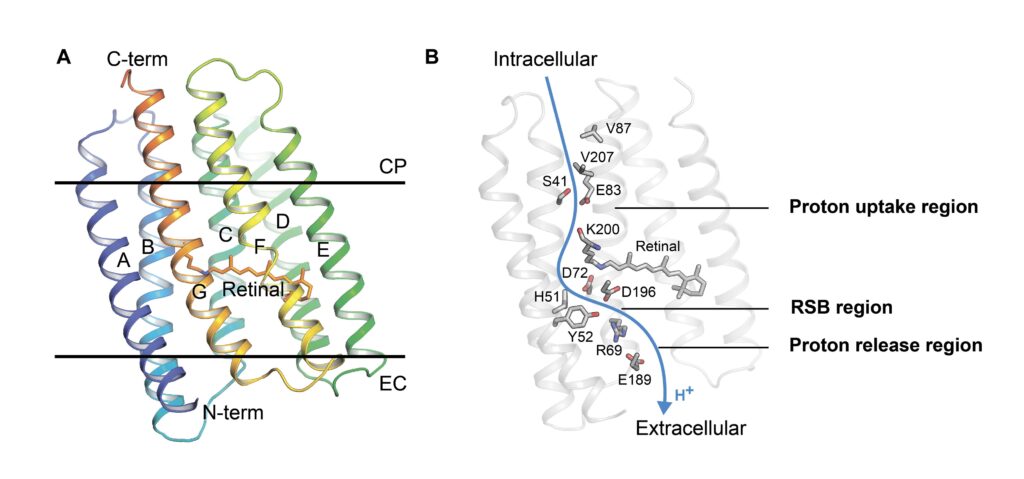
Рисунок 1. (A) Общая структура MAR. Черные линии показывают границы мембраны. (B) Путь переноса протона в MAR. Ключевые аминокислоты показаны в виде палочек. Источник: Science Advances.
Ученые охарактеризовали стадии фотоцикла протеородопсина MAR, а также изменения его структуры в зависимости от реакции среды.
«Нам удалось расшифровать структуру насоса MAR в невероятных подробностях, в том числе очень хорошо рассмотреть положения атомов в канале переноса протона. Более того, мы смогли получить структуры разных переходных состояний, благодаря чему установили, что в процессе транспорта ионов активный сайт белка попеременно доступен то из цитоплазмы, то из внеклеточного пространства, что объясняет действие белка. Вероятно, подобный механизм реализован и в других активируемых светом ионных насосах, хотя и не так наглядно», — прокомментировал Иван Гущин, руководитель лаборатории структурного анализа и инжиниринга мембранных систем МФТИ.