Данила Зименков (ИМБ РАН, Москва) рассказал о новой детерминанте устойчивости к бедаквилину, которую они вместе с коллегами из Новосибирска нашли в российских изолятах. Бедаквилин — противотуберкулезный препарат нового поколения, мишенью которого является АТФ-синтаза микобактерий. Угнетение продукции АТФ приводит к гибели бактериальных клеток. Бедаквилин появился в 2012 году и открыл новую эру в терапии туберкулеза, в том числе лекарственно-устойчивого.
Механизмы устойчивости к самому бедаквилину основаны на изменении сайта-связывания (мутации в гене atpE с-субъединицы АТФ-синтазы) или на эффлюксе (оттоке) препарата из клетки. Эффлюкс обеспечивает транспортерная система MmpS5/L5. Мутации в гене-репрессоре mmpR5 могут приводить приводят к дерепрессии оперона mmpS5-mmpL5 и тем самым к устойчивости.
Докладчик с коллегами проанализировали методом полногеномного секвенирования изоляты от пациентов, получавших лечение бедаквилином, у которых на фоне лечения посев оставался положительным в течение длительного времени. Были широко распространены мутации в генах mmpR5 и atpE. Кроме того, нашли дополнительные мутации в генах mmpL5, mmpL4 и atpB, которые также могут влиять на восприимчивость к бедаквилину. Замена аминокислоты в MmpL5 появилась во время лечения бедаквилином. В одном случае (в восприимчивом штамме) замена в другой субъединице АТФ-синтазы AtpB был обнаружена одновременно с мутацией потери функции в mmpR5. Еще в одном изоляте, резистентном к бедаквилину, вместе с мутацией с потерей функции в mmpR5 присутствовала мутация в гене mmpL4. (MmpL4/S4 — другой микобактериальный транспортер.)
Можно предположить, что мутации в генах mmpL5, mmpS4-mmpL4 и atpB также влияют на резистентность к бедаквилину. Полученные данные подтверждают, что эволюция патогена продолжается.
О лабораторных исследованиях чувствительности M. tuberculosis (Mtb) к деламаниду рассказала Татьяна Смирнова (ФГБНУ «ЦНИИТ», Москва). Препарат деламанид (Дельгиба) японской компании Otsuka одобрен Минздравом РФ в 2020 году и закупается с 2021 года. Лечение этим препаратом получают пациенты с широкой лекарственной устойчивостью (ШЛУ). Клинические исследования по применению у детей еще продолжаются.
Деламанид действ только на туберкулезную микобактерию и является пролекарством: в активную форму его превращает нитроредуктазная система Mtb. Соответственно, устойчивость могут вызывать мутации в генах белков, участвующих в этом процессе: ddn (дезафлавинзависимая нитроредуктаза), fgd1 (глюкозо-6-фосфатдегидрогеназа), а также в генах четырех белков синтеза и реактивации кофактора F420 — FbiA–D. Мутации, ассоциированные с устойчивостью, были найдены во всех шести генах.
Фенотипическая устойчивость определяется бактериологическими методами. Докладчица остановилась на некоторых проблемах: например, однажды завышенные результаты по устойчивости были связаны с недостаточно чистым лекарственным веществом. Теперь для анализа получают чистую субстанцию через производителя и ГК «Р-Фарм». Тем не менее реальная доля устойчивых изолятов составила около 14%, и для них определили мутации устойчивости.
Среди проблем тестирования на лекарственную чувствительность, помимо использования некачественной субстанции, — неправильное ее разведение (деламанид —труднорастворимое в воде вещество), нарушение правил хранения (хранить его следует строго в темноте, в разведенном виде — при -70 °С). Все это может приводить к ложному заключению об устойчивости.
Новые тест-наборы для диагностики лекарственно устойчивых форм туберкулеза представила Юлия Микулович (ФГБУ «ЦСП» ФМБА России).
«АмплиТест МБТ» предназначен для обнаружения ДНК микобактерий туберкулезного комплекса методом ПЦР; «АмплиТест МТБ-Резист-I» и «АмплиТест МТБ-Резист-I Lyo» — для выявления мутаций, связанных с устойчивостью к рифампицину и изониазиду; «АмплиТест МТБ-Резист-II» выявляет мутации устойчивости к фторхинолону. Существует и тест для обнаружения ДНК микобактерий туберкулезного комплекса на основе изотермической амплификации — «АмплиТест МТБ-LAMP». О последних двух новинках докладчица рассказала подробнее.
«АмплиТест МТБ-LAMP» выпускается в четырех формах комплектации, причем некоторые можно хранить в холодильнике, а не в морозилке. Использование изотермической петлевой амплификации обеспечивает быструю детекцию (среднее время проведения анализа 35 минут вместо 90 мин при ПЦР-РВ) при высокой аналитической чувствительности. В одном образце можно проводить детекцию по трем каналам, что дает возможность детекции внутреннего контрольного образца и мишеней в одной пробирке. Тест адаптирован к разным амплификаторам. Для исследования подходит широкий спектр образцов: мокрота, бронхоальвеолярный лаваж, биоптаты и даже моча, а также бактериальные культуры. Клинические испытания, где проводилось сравнение с ПЦР-набором «АмплиТест МБТ», показали полное соответствие результатов.
Набор на основе ПЦР для обнаружения устойчивости к фторхинолонам в качественном формате выявляет мутации в генах gyrA и gyrB. Он также подходит для широкого спектра образцов и поставляется в двух формазх комплектации. Оценка диагностической эффективности, в которой использовался в качестве набора сравнения «MTB-RESIST-II-тест» (ООО «ТестГен»), тоже продемонстрировала 100%-ное соответствие результатов.
Доклад Анастасии Казюлиной назывался «Геномный анализ микобактерий для нужд здравоохранения: опыт секвенирования 2000 культур в лаборатории ФГБУ «НМИЦ ФПИ» Минздрава России».
Заболеваемость и смертность от туберкулеза в России снижаются, и в 2021 году ВОЗ исключила РФ из списка стран с высоким бременем туберкулеза.
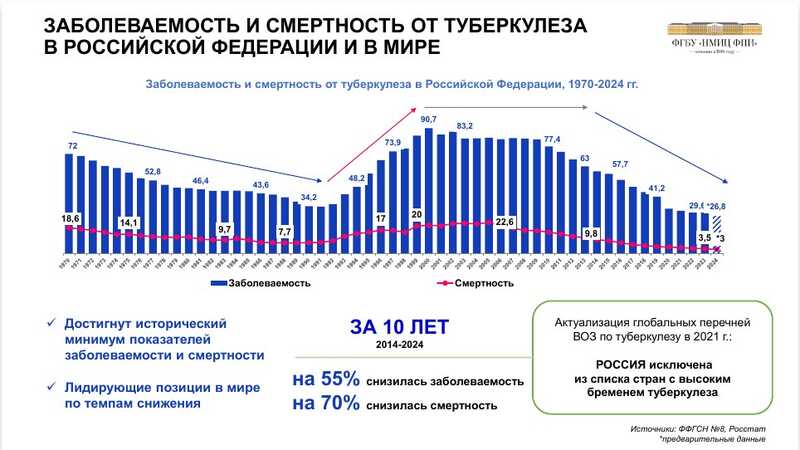
Однако лекарственная устойчивость распространена широко: в России доля пациентов с лекарственно-устойчивым туберкулезом — 37%, тогда как в мире 3,3%. При этом в 27 субъектах не проводятся исследования чувствительности к фторхинолонам (пре-ШЛУ) молекулярно-генетическими методами.
Докладчица представила пример лабораторного алгоритма выявления микобактерий и тестирования лекарственной устойчивости, включающий как микробиологические, так и молекулярные методы.
Если устойчивость к одному или нескольким новым противотуберкулезным препаратам (ПТП) будет выявлена с запозданием, то могут появиться микобактерии с дополнительной устойчивостью, сформируется популяция, обладающая устойчивостью к различным ПТП. Устойчивость к новым препаратам уже сейчас достигает 5% среди новых случаев туберкулеза.
На базе НМИЦ ФПИ создана национальная референсная лаборатория РФ, среди задач которой — верификация возбудителя туберкулеза, микобактериозов и ассоциированных инфекций, определение лекарственной устойчивости, а также совершенствование работы лабораторной службы, контроль качества исследований, обучение и консультации.
На данный момент проведен полногеномный анализ 2010 культур микобактерий из регионов РФ. Выявлены мутации, ассоциированные с устойчивостью к рифампицину, фторхинолонам, бедаквилину, деламаниду и претоманиду, линезолиду. Примечательно, что мутации, потенциально вызывающие устойчивость к бедаквилину, характеризуются значительным разнообразием. Ни один тест на основе ПЦР не даст такой полной картины, подчеркнула докладчица.
Анна Вязовая (НИИ эпидемиологии и микробиологии им. Пастера, Санкт-Петербург) рассказала о геномной эпидемиологии туберкулеза в Омской области.
Россия выведена из списка стран с высокой заболеваемостью туберкулезом, но остается в числе 30 стран с высоким бременем ЛУ (7,4% всех случаев в мире, тогда как, например, в Индии 27%). Заболеваемость туберкулезом в разных регионах существенно различается: самые высокие показатели в Сибирском и Дальневосточном федеральных округах.
В Омской области в последнее десятилетие заболеваемость падает, как и на всей территории РФ. В 2023 году она составляла 42,5 человек на 100 тыс. населения, что меньше, чем в среднем по СФО, и примерно в полтора раза меньше, чем в 2013 году. Однако доля носителей туберкулезных микобактерий с множественной лекарственной устойчивостью (МЛУ-ТБ) среди новых инфицированных превышает 30%.

Большую эпидемиологическую значимость имеют штаммы Восточно-Азиатской сублинии L2 (Beijing). К ней относится и ряд штаммов, циркулирующих на территории РФ.
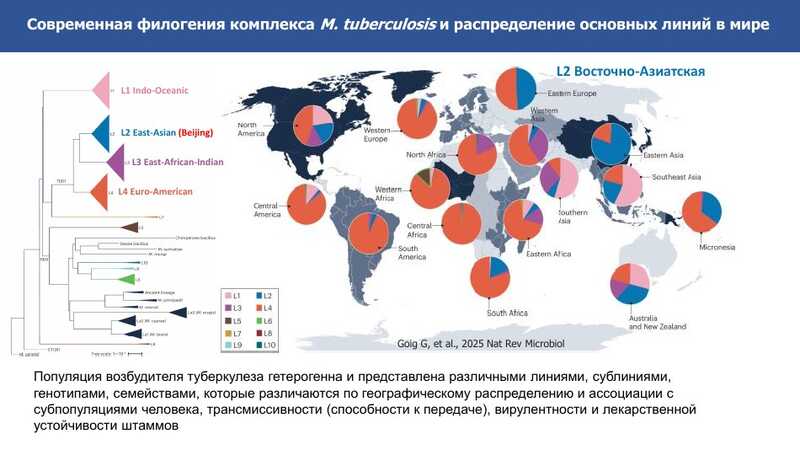
Докладчица призвала пользоваться более глубокой номенклатурой при описании штаммов в публикациях: сообщение о принадлежности штамма к сублинии Beijing неинформативно ввиду ее широкого распространения и разнообразия.
В ходе молекулярно-генетического мониторинга популяции Mtb в Омской области проводился геномный анализ штаммов с пред-широкой первичной ЛУ (пре-ШЛУ). Было изучено 720 штаммов, выделенных в 2019–2023 гг. от впервые выявленных больных, почти треть которых была также инфицирована ВИЧ. Идентифицировали с помощью ПЦР принадлежность штаммов к генотипу Beijing, выявляли его субтипы B0/W148, Central Asian/Russian (CAO), Central Asian Outbreak (CAO). Штаммы, принадлежащие к другим сублиниям, генотипировали методом сполиготипирования. Для штаммов с пре-ШЛУ выполняли полногеномное секвенирование.
Лекарственной устойчивостью обладали более половины штаммов, и более 70% составляли штаммы Beijing. Среди МЛУ и пре-ШЛУ их было еще больше (86% и 92% соответственно).
Доля штаммов линии L4 среди МЛУ и пре-ШЛУ-штаммов снижалось, за исключением генотипа Ural (SIT262). Хотя пока он немногочислен, за ним необходимо наблюдать.
Как показало полногеномное секвенирование штаммов с пре-ШЛУ, у некоторых из них встречаются мутации, ассоциированные с устойчивостью к бедаквилину. Эти три штамма субтипа B0/W148, по сути, уже обладают ШЛУ. В целом штаммы линии B0/W148 играют ключевую роль в распространении туберкулеза с МЛУ и пре-ШЛУ на территории области.
Отвечая на вопросы, Анна Вязовая заметила, что врачи интересуются данными геномной эпидемиологии и находят взаимосвязи между случаями, когда анализ геномов указывает на то, что такие связи должны существовать. Понимание путей распространения инфекции может способствовать его пресечению.
Темой доклада Олега Огаркова, директора Института эпидемиологии и микробиологии НЦ ПЗСРЧ (Иркутск), была история туберкулезной инфекции и особенности эпидемического процесса на территории ДФО.
В монографии докладчика с соавторами ранее было высказано предположение, что распространение генотипа Beijing на территории страны обусловлено массовыми переездами людей из Китая в СССР. В 1891 году началось строительство Транссибирской магистрали, а в 1935 году из Китая вернулось около 20 тысяч бывших сотрудников Китайской восточной железной дороги (части Транссиба) и членов их семей. Эти люди долго прожили в очаге распространения Beijing. В 1937 году все служащие КВЖД были объявлены «японскими шпионами», арестованы, и многие оказались в исправительно-трудовых лагерях. Можно предположить, что именно так Beijing распространился в системе советских пенитенциарных учреждений. На то, что распространение произошло именно в СССР, а не раньше, указывает отсутствие штаммов Beijing в Финляндии и Польше, которые входили в состав Российской империи.
Туберкулез сопровождает человека на протяжении тысячелетий. Древнейшая находка туберкулезных микобактерий на сегодняшний день — ДНК M. bovis в костях бизона, жившего более 17 тысяч лет назад на территории штата Вайоминг (США). Если говорить о M. tuberculosis у людей, то древнейший образец — ДНК из костей матери и ребенка, найденных в некрополе поселения Атлит-Ям (Израиль); их возраст около 9000 лет. На территории современной Тувы в могильнике Аймырлыг были найдены останки человека возрастом более 2000 лет, в которых обнаружилась ДНК M. bovis.
Олег Огарков привел интересный факт, установленный в их работе 2017 года: МЛУ-ШЛУ штаммы Beijing в Якутии значимо чаще встречались у молодых людей (после 1990 года рождения), чем у пожилых (до 1959 года рождения), а в Иркутской области такой закономерности не обнаруживается. Следовательно, в Якутию Beijing проник позже, чем в другие регионы России, вероятно, во время миграционных событий, связанных с освоением Севера. В послевоенное время, когда люди начали возвращаться из мест лишения свободы, на территории СССР происходит взрывообразное распространение новых генотипов. Сейчас в Якутии такого различия между поколениями уже не наблюдается, добавил докладчик, встречаемость МЛУ-ШЛУ выросла везде.
Еще одна находка из Якутии — генотип S подтипа L4.4.1. Было продемонстрировано его сходство со штаммами, обнаруженными в европейских странах, а также у аборигенов Аляски, в Канаде и Новой Зеландии. Занос в Якутию и в Америку, по-видимому, произошел независимо, это два разных события. В Якутию генотип S, скорее всего, принесли русские поселенцы в конце XVII века, а на территории Америки он появился раньше.
Важная тема — готовность научных результатов к практическом применению. Докладчик привел ряд перспективных примеров: обнаружение варианта в промоторе гена CD209, который влияет на экспрессию этого рецептора на дендритных клетках и сцеплен с летальностью от генотипов линии L2, но не L4; SNP-идентификация штаммов методом TaqMan ПЦР; и наконец, выявление в геноме пациентов SNP (rs1495741), который с высокой точностью предсказывает тип ацетилирования ксенобиотиков (и тем самым — скорость ацетилирования и выведения распространенного противотуберкулезного препарата изониазида). Создан набор реагентов для определения этого полиморфизма методом ПЦР-РВ.
Тему генетических факторов, влияющих на восприимчивость к туберкулезу, продолжил Андрей Девяткин (ФГБУ «ЦСП» ФМБА России; НИИ медицины труда им. А.В. Измерова). В мире около 2 млрд человек инфицированы микобактерий, но лишь примерно у 5–15% развивается активная форма туберкулеза. В разных регионах варьирует доля людей, которые являются носителями, но сами не болеют. Очевидно, что на заболеваемость влияют факторы среды, но и генетические факторы важны. Их изучение может помочь в создании инструментов предиктивной стратификации, позволяющих оценить риск для конкретных людей.
Представление об индивидуальных вариациях восприимчивости к туберкулезу возникло еще в первой половине XX века. Докладчик упомянул «катастрофу в Любеке» 1929 года: 251 новорожденному ввели перорально вакцину БЦЖ, в которой оказалась живая M. tuberculosis. Из этих детей 173 пережили инфекцию, хотя ее признаки проявились, а 72 умерли от туберкулеза. В 1936 году наследуемость чувствительности к туберкулезу изучали путем наблюдения за 205 парами близнецов. У однояйцевых конкордантность составила 65%, у разнояйцевых 25%.
Ранние данные указывали на то, что какие-то генетические детерминанты существуют, но в рамках GWAS (а их было проведено не менее 18) не удавалось получить убедительных результатов.
Андрей Девяткин с соавторами сделали предположение, что полигенный подход может быть более релевантным, чем поиски «гена восприимчивости к туберкулезу», и предложили практические рекомендации. Докладчик напомнил, как рассчитывается полигенная оценка риска (PRS), учитывающая влияние нескольких SNP, иногда значительного их количества.
Хорошо известны истории успеха PRS, например, рабочие полигенные оценки риска для диабета 1 типа. Однако для инфекционных заболеваний их практически нет. Было проведено исследование, в котором больных туберкулезом и условно здоровых жителей Китая генотипировали с помощью одного и того же чипа на 402 SNP, на основе которых рассчитывалась восприимчивость к респираторным заболеваниям. Из них для туберкулеза использовали 120 SNP, и удалось статистически значимо (но со значительным перекрыванием) различить больных и здоровых.
Следует помнить об этнической специфичности PRS, напомнил докладчик: данные, полученные на одной популяции, могут не подойти для другой. Тем не менее можно представить, что в будущем определение SNP, значимых для протекания туберкулезной инфекции, станет частью персонализированной профилактики и терапии.
О сравнении различных молекулярных методов исследования респираторной микробиоты при туберкулезе легких рассказала. Татьяна Умпелева (Уральский НИИ фтизиопульмонологии — филиал ФГБУ «НМИЦ ФПИ» Минздрава России, Екатеринбург). Даже в норме легкие человека не стерильны, вопреки представлениям домикробиомной эпохи. Микробиом легких влияет на течение COVID-19 и рака легких. У пациентов с туберкулезом он легких может быть диагностической или терапевтической мишенью, отметила докладчица.
Изменения микробиома при туберкулезе еще недостаточно изучены, но можно отметить, что уменьшается его разнообразие. Длительная противотуберкулезная терапия также может существенно изменить микробное сообщество легких.
Для исследования микробиоты легких докладчица с коллегами использовали масс-спектрометрию микробных маркеров (жирных кислот, альдегидов и т.п.). Этот подход позволил выявить 57 микроорганизмов в бронхиальных смывах пациентов, включая микобактерии. На основе данных о 10 микроорганизмах исследователи рассчитывали коэффициент, значение которого коррелировало с особенностями туберкулезного процесса (в числителе — «хорошие» микроорганизмы, в знаменателе — «плохие»). Однако полученные данные, в частности, о доминирующих таксонах, расходились с литературными.
Исследователи подключили молекулярные методы — использовали доступные на рынке наборы для выявления микроорганизмов методом ПЦР-РВ. В некоторых образцах большая часть бактерий не идентифицировалась.
Нанопоровое секвенирование генов 16S рРНК провели для 17 образцов, и полученные таким образом данные о разнообразии микробиоты соответствовали литературным. Результаты нанопорового секвенирования и ПЦР-РВ несколько различались: представленности совпадали для большинства микроорганизмов, однако секвенирование не «видело» ДНК микобактерий и коринебактерий, показывало более высокие доли Haemophilus, меньшие доли Prevotella и Porphiromonas, возможно, из-за особенностей таксономии.
Таким образом, данные молекулярно-генетических исследований не подтверждают данные масс-спектрометрии микробных маркеров, которые в то же время показывают хорошую связь с особенностями клинического течения туберкулеза. Возможное решение — перейти на анализ жирных кислот, альдегидов и стеринов, без привязки к таксонам микроорганизмов. Первые результаты обнадеживают, отметила докладчица, однако необходима стандартизация методологии исследованийй.
Завершил секцию доклад Егора Шитикова (ФГБУ ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России) о российской коллекции микобактериофагах и их терапевтическом потенциале.
На слайде, посвященном истории изучения бактериофагов (Эрнест Хэнкин, Н.Ф. Гамалея, Фредерик Туорт, Феликс д’Эррель), докладчик отметил оранжевой кривой интерес научного сообщества к бактериофагам. Ожидаемо, он резко упал после открытия антибиотиков, но начал расти по мере снижения темпа разработки новых препаратов и появления антибиотикорезистентности.
Сейчас есть достаточно много работ по фаготерапии микобактериальных инфекций. Большой интерес вызывает фаг Muddy.
Докладчик рассказал о двух программах Альянса научного образования, SEA-PHAGES (поиск фагов в природе и их геномика) и SEA-GENES (исследование функций генов фагов). Это простые программы, «больше для бакалавров, чем для магистрантов», сказал Егор Шитиков. Однако благодаря им не только молодые ученые получили необходимую подготовку, но и были выделены десятки тысяч бактериофагов, охарактеризованы тысячи геномов.
Микобактериофаги уже находят применение в терапии, примеры можно найти в научной литературе. В лаборатории иммунопатологии и иммунодиагностики туберкулезной инфекции НМИЦ фтизиопульмонологии и инфекционных заболеваний работают с литическим фагом D29.
Фаг Vic9 (подкластер В2), недавно выделенный Егором Шитиковым с коллегами, заражает M. smegmatis, демонстрирует также литическую активность против M. tuberculosis, однако спектр его хозяев достаточно узок. (Подробнее на PCR.NEWS.)
Бактериофаг Yasnaya_Polyana (K4) относится к лизогенным, что препятствует его терапевтическому использованию. Однако сконструированная авторами исследования мутантная форма с делецией репрессорного гена обладала литической активностью против M. tuberculosis. Некоторые другие фаги, делеции в геномах которых затрагивают ген интегразы, также ингибируют рост микобактерий и могут использоваться для борьб ы с ними.
Информация о докладчиках
Зименков Данила Вадимович, к.б.н., ФГБУН ИМБ РАН, Москва
Смирнова Татьяна Геннадьевна, к.м н. ФГБНУ «ЦНИИТ», Москва
Микулович Юлия Львовна, к.х.н., ФГБУ «ЦСП» ФМБА России, Москва
Казюлина Анастасия Александровна, ФГБУ «НМИЦ ФПИ» Минздрава России, Москва
Вязовая Анна Александровна, д.б.н. НИИ эпидемиологии и микробиологии им. Пастера, Санкт-Петербург
Огарков Олег Борисович, д.м.н., директор Института эпидемиологии и микробиологии НЦ проблем здоровья семьи и репродукции человека, Иркутск
Девяткин Андрей Андреевич, к.б.н., ФГБУ «ЦСП» ФМБА России; НИИ медицины труда им. А.В. Измерова, Москва
Умпелева Татьяна Валерьевна, к.б.н. Уральский научно-исследовательский институт фтизиопульмонологии - филиал ФГБУ «НМИЦ ФПИ» Минздрава России, Екатеринбург
Шитиков Егор Александрович, д.б.н. ФГБУ ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России, Москва